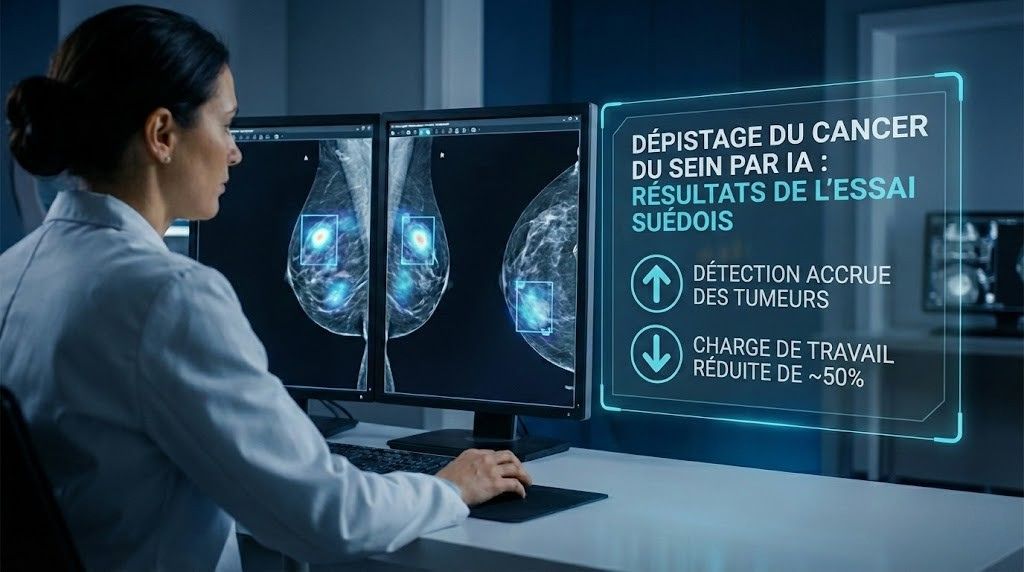
Le dépistage du cancer du sein est un pilier de santé publique, mais il repose sur une ressource rare : le temps et l’expertise des radiologues. Or, avec l’augmentation des volumes d’examens, la pression opérationnelle s’intensifie, au risque d’allonger les délais, d’augmenter la fatigue de lecture et de rendre plus difficile la détection de tumeurs discrètes. Des chercheurs suédois viennent de publier les résultats d’un essai à grande échelle sur un dépistage assisté par intelligence artificielle (IA) : l’outil aurait permis de repérer une proportion plus élevée de tumeurs tout en réduisant presque de moitié la charge de travail des radiologues. Concrètement, cela ouvre des perspectives majeures pour les programmes de dépistage, à condition d’aborder la mise en œuvre avec méthode, gouvernance et exigences cliniques strictes.
Ce que montre l’essai suédois : deux effets clés
Le cœur du résultat est double : amélioration de la détection et réduction de la charge de lecture. Dit autrement, l’IA ne sert pas seulement à « aller plus vite », elle semble aussi aider à « mieux voir ». C’est précisément la combinaison recherchée dans un workflow de dépistage : préserver (voire améliorer) la performance clinique tout en absorbant un volume croissant d’examens.
1) Une détection accrue des tumeurs
L’essai rapporte que l’IA a aidé les radiologues à identifier une part plus importante de tumeurs que la lecture sans assistance. En pratique, cela signifie que l’algorithme agit comme un second regard systématique : il met en évidence des zones suspectes, attire l’attention sur des signaux faibles et réduit la probabilité qu’une lésion passe inaperçue lors d’une lecture sous contrainte de temps.
Pour un programme de dépistage, une meilleure détection peut se traduire par des diagnostics plus précoces, donc potentiellement par des traitements moins lourds et de meilleurs pronostics. Toutefois, toute hausse de détection doit être interprétée en regard des indicateurs de qualité (rappels, faux positifs, biopsies inutiles) et des caractéristiques des tumeurs détectées.
2) Une charge de travail radiologique presque divisée par deux
Le second enseignement, très opérationnel, est la réduction importante de la charge de travail. Selon les résultats publiés, le dispositif a permis de diminuer quasi de moitié la quantité de lectures à effectuer. Cela peut correspondre à différents modèles organisationnels : triage des examens jugés « très probablement normaux », priorisation des cas plus complexes, ou reconfiguration de la double lecture traditionnelle.
Dans un contexte de tension sur les ressources (pénurie de radiologues, croissance des populations éligibles au dépistage), cet effet « capacité » est déterminant. Il peut réduire les délais de compte-rendu, limiter la surcharge, et améliorer l’expérience des équipes, tout en stabilisant la qualité.
Comment l’IA s’intègre réellement dans un workflow de dépistage
Pour passer du résultat d’un essai à un bénéfice terrain, la question n’est pas « IA ou pas IA », mais « quel rôle exact pour l’IA, et avec quel contrôle ». Un déploiement réussi clarifie le niveau d’autonomie, le circuit de décision et les responsabilités.
Les principaux modèles d’usage
On distingue généralement trois approches, à sélectionner selon la maturité du programme et le cadre réglementaire :
Assistance à la lecture (second reader numérique) : l’IA fournit des marqueurs, scores de suspicion ou cartes de chaleur, et le radiologue décide. L’objectif est d’augmenter la sensibilité sans bouleverser complètement les habitudes.
Triage : l’IA classe les examens selon leur probabilité d’anomalie pour prioriser les lectures (ou proposer un parcours accéléré). L’objectif est d’optimiser le temps humain là où il est le plus utile.
Réorganisation de la double lecture : dans certains systèmes, deux lecteurs humains évaluent les mammographies. L’IA peut remplacer partiellement le second lecteur, ou être intégrée comme lecteur additionnel, afin de réduire le volume total de double lectures tout en maintenant une performance élevée.
Ce que « réduire la charge de travail » signifie sur le terrain
Réduire la charge ne signifie pas seulement « lire moins ». Cela peut permettre de réallouer du temps vers des tâches à plus forte valeur : concertations, corrélations multimodales, échanges avec les équipes, supervision qualité, formation, ou lecture approfondie des cas complexes. Dans une logique de performance durable, l’IA devient un levier de capacity planning, pas simplement un outil de productivité.
Bénéfices attendus pour les patientes, les radiologues et le système de santé
Pour les patientes : détection plus précoce et délais potentiellement réduits
Si la détection est réellement améliorée sans explosion des faux positifs, l’impact principal est la découverte plus tôt de tumeurs qui auraient pu être identifiées plus tard. Un autre bénéfice possible est la réduction du temps d’attente entre l’examen et le résultat, si la charge de lecture diminue effectivement.
Pour les radiologues : réduction de la surcharge et meilleure focalisation
Les programmes de dépistage impliquent des volumes massifs d’images répétitives. L’IA peut agir comme une couche de sécurité et de priorisation, diminuant la fatigue décisionnelle et permettant aux radiologues de concentrer leur expertise sur les situations ambiguës.
Pour les organisations : performance, throughput et pilotage qualité
À l’échelle d’un réseau, l’IA peut augmenter le throughput, stabiliser les temps de cycle, et soutenir une standardisation des pratiques. Elle peut aussi fournir des métriques additionnelles (scores, distribution des alertes, variations par site) utiles pour le quality management.
Points de vigilance : ce qu’il faut vérifier avant de généraliser
Des résultats prometteurs ne dispensent pas d’une évaluation rigoureuse, car le dépistage est particulièrement sensible aux effets indésirables (anxiété, examens complémentaires, surdiagnostic). Avant toute adoption à large échelle, plusieurs aspects doivent être cadrés.
Faux positifs, rappels et surdiagnostic
Une IA qui détecte davantage peut aussi générer plus d’alertes. L’enjeu est de mesurer l’équilibre entre sensibilité et spécificité : combien de cancers supplémentaires détectés pour combien de rappels supplémentaires ? L’objectif n’est pas seulement « plus de détections », mais « mieux de détections », en limitant les examens inutiles et l’impact psychologique sur les patientes.
Généralisation des performances : population, machines, protocoles
Un modèle entraîné ou validé dans un contexte donné peut perdre en performance ailleurs. Il faut vérifier la robustesse selon l’âge, la densité mammaire, les équipements d’imagerie, les protocoles d’acquisition, et les pratiques locales. Cela implique une validation locale, idéalement prospective, et un monitoring continu après déploiement.
Workflow et responsabilité clinique
Qui décide en cas de désaccord entre l’IA et le radiologue ? Comment documenter l’utilisation de l’IA dans le compte-rendu ? Comment éviter une dépendance excessive à l’outil (automation bias) ? Ces questions doivent être tranchées par une gouvernance clinique claire et des procédures écrites.
Conformité, sécurité et données
Un système d’IA en imagerie médicale implique des exigences fortes : sécurité, traçabilité, contrôle des accès, conservation des logs, gestion des mises à jour du modèle, et respect du cadre applicable (protection des données de santé, exigences de dispositif médical selon les juridictions). Le déploiement doit associer radiologie, IT, sécurité, juridique et direction qualité.
Guide de mise en œuvre : déployer une IA de dépistage de façon actionnable
Pour transformer l’essai clinique en valeur opérationnelle, une approche par étapes limite les risques et permet de démontrer le ROI clinique et organisationnel.
Étape 1 : définir les objectifs et les KPI
Commencez par formaliser une charte d’objectifs : augmenter la détection, réduire le temps de lecture, diminuer les délais de rendu, améliorer la robustesse du programme. Associez-y des KPI mesurables : taux de détection, taux de rappel, taux de biopsie, temps moyen par examen, délais, concordance interlecteurs, et événements indésirables.
Étape 2 : choisir le rôle de l’IA dans le workflow
Décidez si l’IA est un outil d’assistance, de triage, ou un composant de reconfiguration de la double lecture. Cette décision détermine les impacts humains, les besoins de formation, la documentation, et les mécanismes de contrôle qualité.
Étape 3 : conduire une validation locale
Avant un déploiement complet, réalisez une phase pilote sur un volume représentatif. Comparez les performances avec et sans IA, mesurez les KPI, analysez les cas discordants, et identifiez les situations où l’IA apporte le plus (ou au contraire se trompe). Cette étape est essentielle pour instaurer la confiance des équipes et ajuster les seuils d’alerte.
Étape 4 : former et accompagner le changement
La réussite dépend de l’adoption. Prévoyez une formation centrée sur l’interprétation des sorties de l’IA, les limites de l’outil, les cas d’usage recommandés, et la conduite à tenir en cas de désaccord. L’accompagnement doit inclure un feedback loop : collecte des retours utilisateurs, revue régulière des erreurs, et ajustement du protocole.
Étape 5 : mettre en place un monitoring continu
Après déploiement, suivez les KPI dans la durée. Surveillez la dérive (changement de machines, de population, de protocoles), l’impact sur les rappels, et la stabilité des performances. Encadrez les mises à jour du modèle comme des changements critiques, avec validation et traçabilité.
Ce que cette avancée change pour l’avenir du dépistage
Les résultats suédois s’inscrivent dans une tendance de fond : l’IA devient une brique d’infrastructure des parcours d’imagerie, au même titre que les systèmes de lecture et d’archivage. Le potentiel n’est pas uniquement technologique, il est organisationnel : réallouer l’expertise humaine, sécuriser la qualité, et absorber la demande.
À moyen terme, on peut aussi envisager des programmes plus personnalisés, où la fréquence de dépistage et la stratégie d’imagerie s’adaptent davantage au profil de risque. Mais cette évolution suppose des preuves cliniques solides, une transparence des modèles, et une gouvernance éthique.
Conclusion
Le plus grand essai suédois sur le dépistage du cancer du sein assisté par IA suggère un double gain particulièrement recherché : détecter davantage de tumeurs tout en réduisant fortement la charge de travail des radiologues. Pour les systèmes de santé, c’est une piste crédible face à la hausse des volumes et à la contrainte de ressources. La condition de réussite reste la même partout : intégrer l’IA dans un workflow maîtrisé, mesurer des KPI pertinents, sécuriser la conformité et maintenir un monitoring continu. Utilisée comme un copilote clinique plutôt qu’un substitut, l’IA peut devenir un accélérateur de qualité et de capacité dans le dépistage.